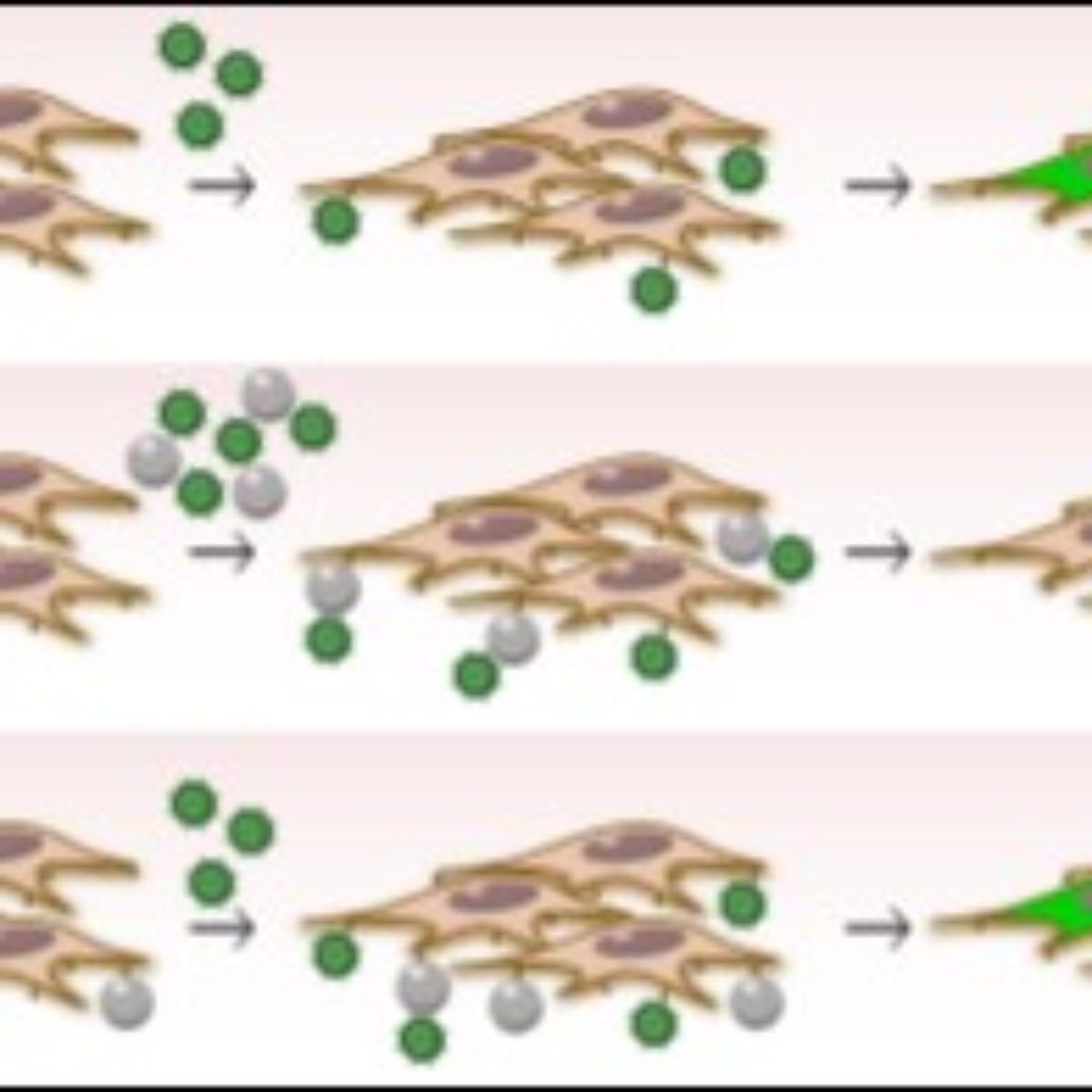
Figura 1: Esquema do processo de transdução viral na ausência e na presença de nanopartículas
Resultados demonstram pela primeira vez a atividade antiviral de nanopartículas de mSiO2.
Vírus estão entre os agentes patogênicos mais nocivos e são responsáveis pela morte de milhões de pessoas a cada ano. Mesmo após o desenvolvimento de terapias anti-retrovirais que melhoraram a qualidade de vida e aumentaram a expectativa de vida de pacientes portadores de HIV/AIDS, o vírus da imunodeficiência humana (HIV) sozinho foi responsável pela morte de 1,2 milhão de pessoas em 2014.
O desenvolvimento de novas estratégias para combater os vírus é necessário, uma vez que terapias antivirais e outras vacinas eficientes não estão disponíveis para muitas doenças virais. As nanoestruturas especialmente desenhadas para o combate a vírus emergiram como uma alternativa possível, uma vez que mostraram atividade contra diferentes vírus, incluindo a hepatite B, o vírus da imunodeficiência humana, o vírus do herpes simplex, o vírus sincicial respiratório, o adenovírus, o vírus da Influenza (gripe comum) e o vírus H1N1 da influenza A. Contudo, não se sabe muito sobre os mecanismos da ação antiviral dessas nanoestruturas.
A concepção de novas nanoestruturas antivirais deve considerar dois objetivos principais: o controle eficaz da infecção viral e da citotoxicidade relacionada com a exposição de materiais biológicos a estruturas de tamanho submicrométrico. Nesse cenário, a sílica é uma ótima alternativa quando se deseja um material funcional, biocompatível, não tóxico e inerte. Além disso, pode ser facilmente sintetizado e manipulado para apresentar propriedades químicas de superfície específicas ou estruturas porosas que permitam o carregamento e liberação de fármacos.
Ligantes enxertados na superfície da sílica podem ser usados para ajustar as propriedades físico-químicas de partículas, tais como sua hidrofobicidade e potencial Zeta (carga elétrica que uma partícula adquire devido aos íons circundantes em solução), que dita fortemente a interação de nanopartículas com células e vírus.
Para abordar o mecanismo de ação das nanopartículas antivirais, a pesquisadora Juliana M. de Souza e Silva [1] e colaboradores sintetizaram nanopartículas de sílica mesoporosa com distintos grupos de superfície, apresentando, portanto, distintas propriedades superficiais. Eles desenvolveram uma série de experimentos para avaliar sua biocompatibilidade e sua capacidade de inibir a transdução do vírus a partir das células alvo e realizaram ensaios de transdução in vitro em culturas celulares, usando um vetor lentiviral recombinante manipulado para expressar o gene repórter GFP (proteína fluorescente verde).
Cada partícula de vírus transduz uma única célula, que irá então expressar o gene repórter, marcando assim a célula infectada para microscopia de fluorescência e citometria de fluxo. A transdução é mediada pelo envelope do vírus, de modo que foram geradas duas preparações diferentes de um vírus recombinante: um que possui o vector lentiviral GFP que aloja um envelope VSV-G (glicoproteína G do vírus da estomatite vesicular) e outro que tem o lentivetor GFP que aloja um envelope derivado de HIV- Gp120.
PREPARAÇÃO E CARACTERIZAÇÃO
Foram preparadas nanopartículas de sílica contendo diferentes grupos de superfície. As partículas foram sintetizadas por hidrólise e condensação de ortosilicato de tetraetilo (TEOS) sob condições básicas. Depois disso, exibiram grupos silanol Si-OH em suas superfícies. Os grupos orgânicos foram enxertados na superfície das nanopartículas de sílica quando um alcoxissilano organofuncional foi adicionado ao meio reacional. Após adição de (3-aminopropil) trietoxisilano (APTES), (3 glicidiloxipropil) trimetoxisilano (GPTMS) ou trimetoxi (2-feniletil) silano (TMPES), a superfície de sílica apresentou, respectivamente, grupos aminopropil, glicidiloxipropil ou feniletil, em adição aos grupos -OH. Eles foram denominados $\rm mSiO_{2}$-TEOS, $\rm mSiO_{2}$-APTES, $\rm mSiO_{2}$-GPTMS e $\rm mSiO_{2}$-TMPES.
As partículas sintetizadas têm um raio de algumas centenas de nanômetros com uma forma esférica uniforme e superfícies lisas. Nenhuma característica de superfície distinta entre as partículas de sílica sintetizadas é observada por imagens TEM feitas no Laboratório Nacional de Nanotecnologia (LNNano). Além disso, não há diferença morfológica aparente entre as partículas não funcionalizadas e funcionalizadas. Como esperado, os tamanhos estimados variam ligeiramente entre as partículas e as distribuições de tamanho para mSiO2-TEOS e para $\rm mSiO_{2}$-APTES são centradas em 382 e 354 nm, respectivamente. Para $\rm mSiO_{2}$-GPTMS e $\rm mSiO_{2}$-TMPES, elas são centradas em 372 e 517 nm.
A partir dos resultados SAXS realizados no LNLS, as partículas exibem caráter mesoporoso e mostram a presença de poros periódicos de dimensões nanométricas. As medições de Zeta foram realizadas em KCl 40 mM, PBS (solução salina tamponada com fosfato) e DMEM (solução de cultura de células): os valores variaram de -13,9 a +4,5; de -20,5 a -11,2; e de -22,8 a -17,5 mV em 40 mM de soluções de KCl, PBS e DMEM (meio de cultura de células celular) respectivamente. Diferenças significativas nas cargas globais das nanopartículas destacam que a modificação química da superfície produz materiais com propriedades coloidais distintas.
CITOTOXICIDADE E POTENCIAL INIBITIVO DE mSiO2 PARA PREVENIR A TRANSDUÇÃO VIRAL
A viabilidade celular foi monitorada pelo teste de MTS (ensaio colorimétrico para avaliar a atividade metabólica das células) para estimar a citotoxicidade das partículas preparadas e para definir as condições experimentais. Desta forma, as células foram cultivadas na presença de diferentes concentrações de nanopartículas. As células cultivadas na ausência de partículas de $\rm mSiO_{2}$ foram utilizadas como controle e representaram o total de células saudáveis. A sua resposta foi normalizada para 100% da atividade metabólica das células.
Os resultados parciais são ilustrados na figura acima, descrevendo o processo de transdução viral na ausência e na presença de nanopartículas. As glicoproteínas virais são representadas pelos picos que sobressaem das partículas virais (esferas verdes) e se ligam aos receptores de células mostrados na superfície celular. (A) A preparação viral é adicionada às células. As partículas virais ligam-se às células e são capazes de prosseguir com o processo de transdução. O genoma viral (que codifica GFP) é integrado no genoma celular e após 48 h de infecção, as células expressam GFP e aparecem verdes sob a luz laser apropriada. (B) No primeiro ensaio realizado com o vírus derivado do HIV, as partículas de $\rm mSiO_{2}$ foram primeiro incubadas com as partículas virais durante 1h, depois adicionadas às células. As partículas de $\rm mSiO_{2}$ que interagem fortemente com as partículas virais devido a propriedades hidrofóbicas ou hidrofílicas semelhantes irão bloquear a interação direta entre algumas partículas virais e células. Após 48h, algumas células são transduzidas. (C) No segundo ensaio realizado com o vírus derivado do HIV, as partículas de $\rm mSiO_{2}$ são deixadas em contato com as células durante 1h, depois é adicionada a preparação viral. Nesta situação, as partículas de $\rm mSiO_{2}$ não são capazes de bloquear todos os locais de interação de partículas e células virais, e praticamente todas as células são infectadas após 48h.
Devido às propriedades hidrofóbicas ou hidrofílicas de suas superfícies, as partículas de $\rm mSiO_{2}$ podem estabelecer interações mais fortes com um envelope de vírus específico com propriedades de superfície semelhantes. Em concentrações baixas, as partículas de $\rm mSiO_{2}$ não mostram toxicidade para as células de mamífero testadas e são ainda capazes de reduzir a transdução de um vírus recombinante que aloja envelope VSV-G. Este envelope é amplamente utilizado na investigação básica e foi utilizado em comparação com outro lentivírus recombinante que abriga um envelope de HIV-gp120. As interações das partículas de mSiO2 com um envelope de vírus específico são a base da atividade antiviral das partículas de $\rm mSiO_{2}$, uma vez que as ligações $\rm mSiO_{2}$ de vírus mais fortes perturbam a ligação dos receptores celulares ao envelope do vírus e a capacidade de transdução viral é reduzida até 50%.
Os resultados demonstram pela primeira vez a atividade antiviral de partículas de $\mathbf mSiO_{2}$ e permitem propor um mecanismo de ação antiviral de partículas mSiO2 baseado em interações superficiais entre sílica, células e vírus. Assim, também se poderia explorar a possibilidade de carregar medicamentos antivirais nas partículas mesoporosas de $\rm mSiO_{2}$.
Fonte: [1] Juliana Martins de Souza e Silva, Talita Diniz Melo Hanchuk, Murilo Izidoro Santos, Jörg Kobarg, Marcio Chaim Bajgelman, and Mateus Borba Cardoso. Viral Inhibition Mechanism Mediated by Surface-Modified Silica Nanoparticles. ACS Appl. Mater. Interfaces, 2016, 8 (26), pp 16564–16572. DOI: 10.1021/acsami.6b03342
A pequena rugozidade da interface e os fenômenos de polarização levam a uma maior mobilidade da carga e melhor estabilidade operacional.
Novo catalisador mostra potencial para aplicações industriais que requerem durabilidade e alta estabilidade térmica.