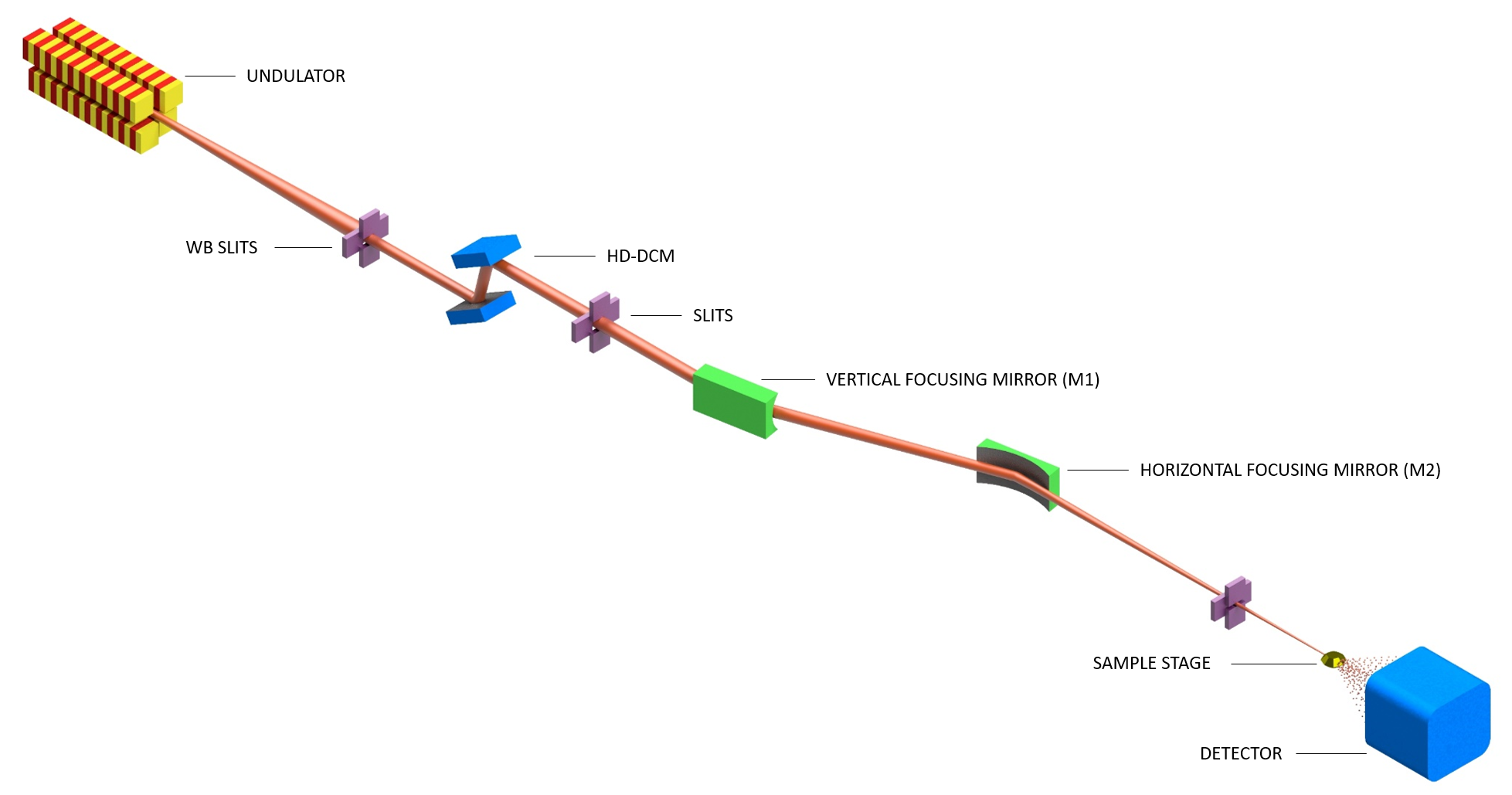
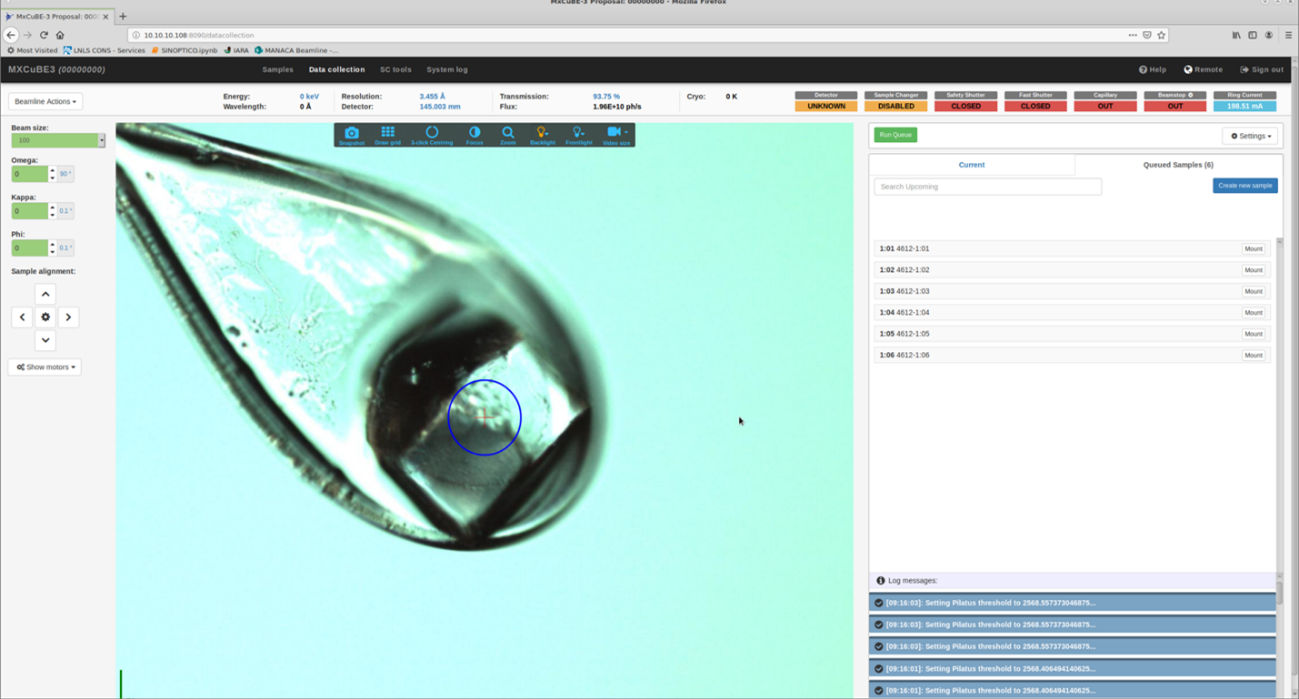
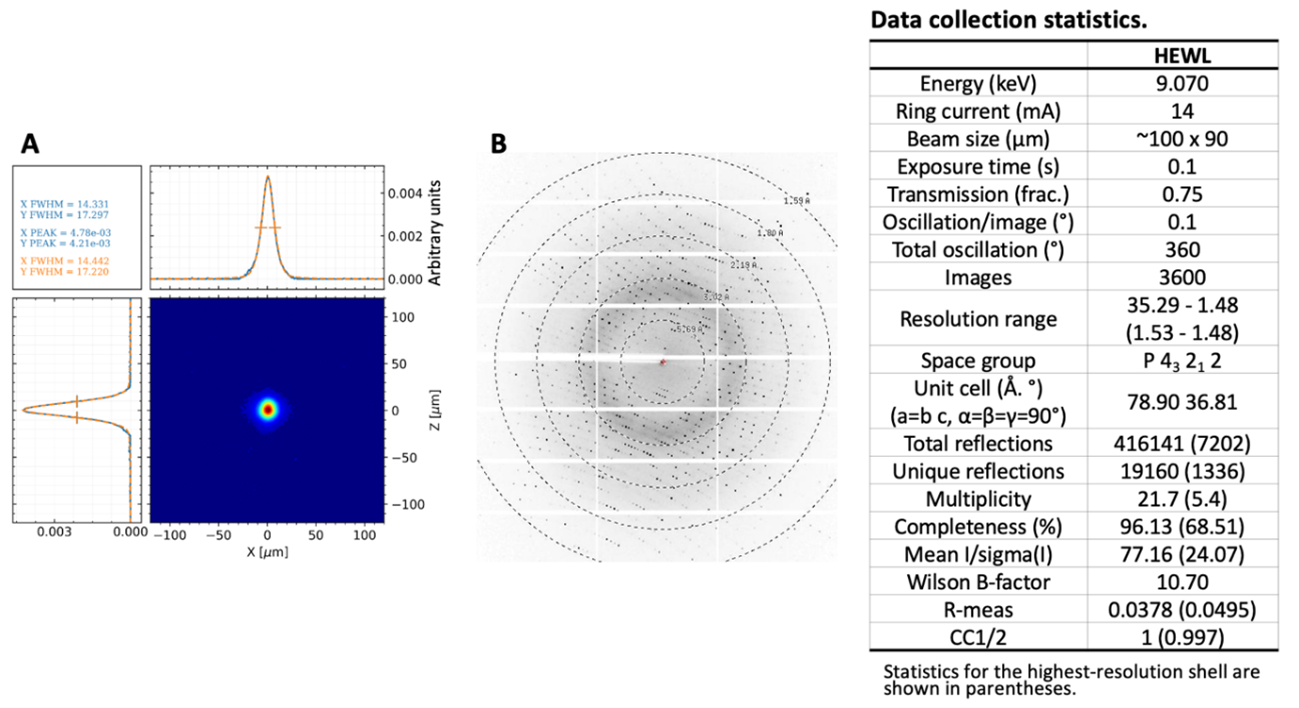
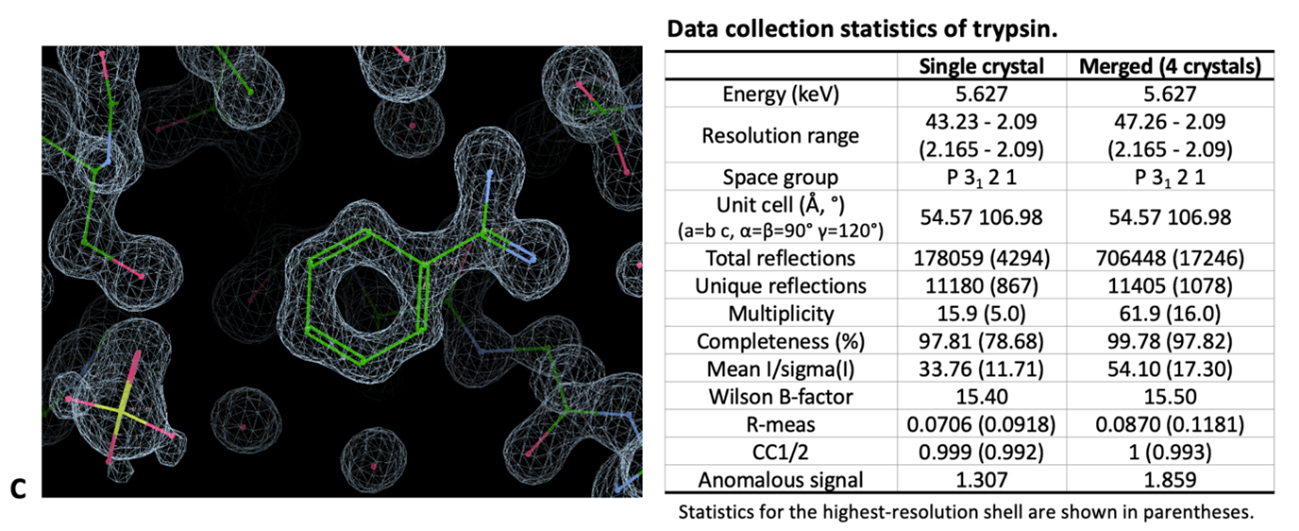
RESOLUÇÂO DE ESTRUTURAS DE PROTEÌNAS
A possibilidade de determinar a estrutura tridimensional das proteínas, ou seja, as posições de cada um dos átomos e suas interações, permitiu o desenvolvimento de novas tecnologias para a descoberta de medicamentos e se tornou um dos exemplos mais marcantes de avanços trazidos pelos síncrotrons. De fato, hoje existem mais de 150000 estruturas proteicas conhecidas registradas no Protein Data Bank (PDB.org), cerca de 80% das quais foram resolvidas com o uso de radiação síncrotron. O Banco de Dados de Proteínas já possui várias estruturas coletadas no LNLS, e algumas já coletadas na linha MANACA empregando estratégias de descoberta de drogas baseadas em fragmentos (FBDD).
A estratégia racional de design de drogas, por exemplo, tenta identificar oportunidades de bloquear ou modificar essas interações moleculares de proteínas. Ao identificar uma proteína como alvo de uma determinada terapia, os estudos estruturais com radiação síncrotron podem mostrar como as drogas se ligam a uma proteína, identificam modificações estruturais para melhorar a ligação da droga, ou mesmo sugerem quais modificações em sua estrutura molecular podem ser feitas sem afetar suas capacidades de ligação.
Alguns dos primeiros exemplos bem sucedidos dessa abordagem, em que a estrutura guia o desenho racional das drogas, incluem o Captopril (Capoten) para o tratamento da hipertensão inibindo enzimas conversantes de angiotensina; Dorzolamida (Trusopt) para o tratamento do glaucoma pela inibição de anidrase carbônica; também muitas das drogas que fazem parte de coquetéis anti-AIDS que inibem a protease do HIV; e drogas Zanamivir (Relenza) e Oseltamivir (Tamiflu) para tratar influenza tipo A e influenza tipo B, também muito utilizado como tratamento durante a pandemia de gripe suína (H1N1) em 2009. Este último inibe uma proteína superficial do vírus da gripe, neuraminidase. No tratamento de alguns cânceres, doenças inflamatórias e diabetes, esse desenho racional tem sido amplamente utilizado nas chamadas quinases. Estas constituem uma classe de enzimas, que participam ativamente da regulação de processos celulares como metabolismo, crescimento e diferenciação. Vários inibidores de quinases desenvolvidos pelo design racional têm sido objeto de ensaios clínicos, sendo o Imatinib mais bem sucedido (Gleevec). Esta droga é usada para tratar leucemia mielóide crônica, tumores estromais gastrointestinais, e muitas outras malignidades. Vale ressaltar também que este foi o primeiro medicamento genérico para tratamento do câncer a ser produzido no Brasil.
Em relação ao tamanho do feixe, os feixes de micron e sub-micron são primordiais para combinar o feixe de raios X com mais precisão com o tamanho do cristal, em experimentos desafiadores (mas frequentemente encontrados) com pequenos cristais, e para sondar pequenas, mas mais uniformes, regiões de um cristal maior, porém menos uniforme. O tamanho dos cristais usados para a cristalografia de raios X é de particular importância porque a intensidade integrada de um pico de difração de raios X de um cristal é proporcional à razão de seu volume de difração ao volume celular unitário. Quanto maior e mais complicada a estrutura proteica se torna, mais desafiadoras são as tarefas necessárias para isolar a proteína intacta e cultivar cristais grandes e bem difundidos. Proteínas de membrana são notoriamente difíceis de cristalizar devido à sua natureza anfílica.
Quanto a amostras mais sensíveis aos danos causados pela radiação, os pequenos feixes permitem rasterar através do cristal para expor amostras frescas a raios X durante toda a coleta de um conjunto de dados. Além disso, há evidências de que uma grande fração dos danos causados pela radiação impingante é causada por fotoelétrons produzidos perto do feixe de raios X. Esses fotoelétrones são preferencialmente ejetados ao longo do vetor de polarização e são mais propensos a depositar sua energia perto do local exposto. Mantendo o tamanho do feixe suficientemente pequeno, a porção exposta da amostra permanece menos danificada do que ao seu entorno.