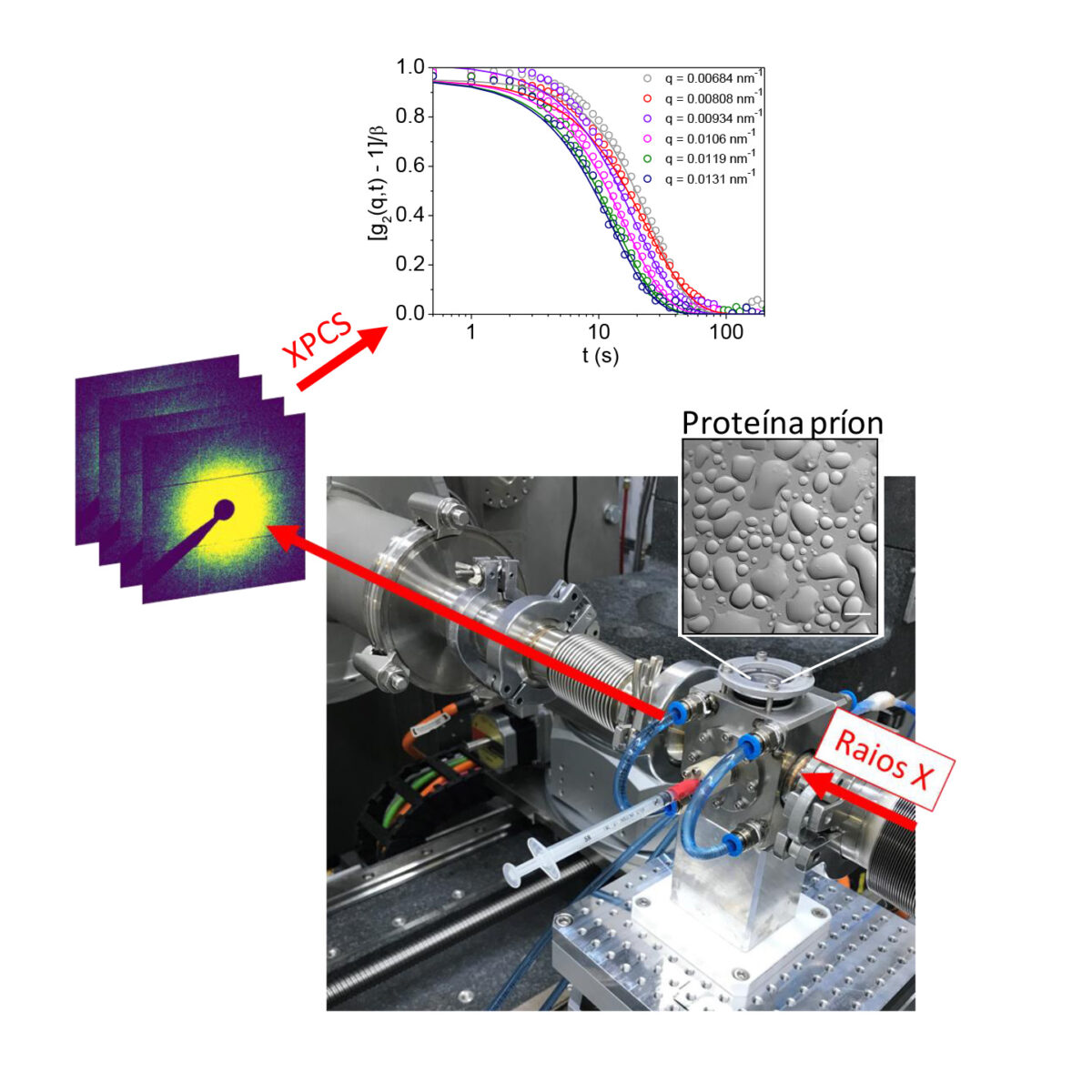
Estudo da dinâmica de agregados de proteína príon por espectroscopia de correlação de fótons de raios X (XPCS) na linha Cateretê do Sirius (Divulgação: CNPEM)
Pesquisadoras brasileiras utilizaram instalações do Sirius para investigar os processos biofísicos relacionados aos príons
O trabalho publicado na revista Science Advances por pesquisadoras brasileiras da Universidade Federal do Rio de Janeiro (UFRJ) utilizou a linha de luz Cateretê, do Sirius, para investigar os mecanismos biofísicos por trás do processo de agregação de proteínas chamadas de príons.
Doenças causadas por príons ou encefalopatias espongiformes transmissíveis são um grupo de doenças neurodegenerativas com longos períodos de incubação e que podem afetar seres humanos e outros animais. Entre as mais conhecidas estão a doença de Creutzfeldt-Jakob e a Encefalopatia Espongiforme Bovina (EEB), popularmente conhecida como “doença da vaca louca”.
Apesar de raras, tais doenças são progressivas, sempre fatais e atualmente não tratáveis. São as únicas doenças transmissíveis conhecidas que são causadas por proteínas e afetam mamíferos.
“Essas proteínas estão presentes em diversos tecidos do nosso corpo, mas especialmente no sistema nervoso central. […] Sua função fisiológica ainda não foi bem definida, mas elas se ligam a metais como o cobre, o que sugere que elas agem como agentes tamponantes e protegem nossas células de processos oxidativos.”, ressalta Yraima Cordeiro, professora da Faculdade de Farmácia da UFRJ e uma das coautoras do artigo.
A proteína príon normal é conhecida na literatura pela notação PrPC e não causa problemas para o corpo humano. Entretanto, quando sua estrutura é alterada para uma forma aberrante, conhecida como PrPSC, ela se torna um agente infeccioso capaz de se ligar à proteína normal e convertê-la em sua forma aberrante. Esse processo em cadeia acaba por causar danos neurológicos significativos e é inevitavelmente fatal.
As doenças causadas por príons podem ser esporádicas, familiares ou adquiridas. A forma esporádica é a mais comum entre seres humanos e acredita-se que acontece por conta de um erro nos processos celulares, fazendo com que a PrPC seja convertida em PrPSC de forma espontânea.Já a forma familiar ocorre por conta de mutações nos genes que codificam a PrPC, tornando-a suscetível a alterações estruturais. Entre as doenças causadas por essas mutações estão a Insônia Familiar Fatal e a Doença de Creutzfeldt-Jakob genética.
Como príons com formas aberrantes possuem a habilidade de se ligar a proteínas normais e convertê-las, algumas dessas encefalopatias são transmissíveis, como é o caso da Doença da Vaca Louca, que pode afetar bovinos ou humanos através da ingestão de carne contaminada com tecido infectado, como farinhas de carne e ossos.
Esse mecanismo, chamado de autorreplicação catalítica foi caracterizado através de importantes estudos que usaram animais que não produziam proteínas príon. “Observou-se que camundongos ou vacas que não produzem príons são resistentes à infecção por príons com forma aberrante, corroborando para a hipótese de que este é o mecanismo por trás das transmissões de doenças priônicas.”, ressalta Yraima.
A Doença da Vaca Louca teve seu primeiro caso diagnosticado em 1986, no Reino Unido. Os sintomas que se manifestam no gado são: dificuldade de locomoção, postura anormal, perda de peso, mudanças de comportamento, tremores e hipersensibilidade a estímulos externos.
Acredita-se que a epidemia de Encefalopatia Espongiforme Bovina (EEB) nos anos 80 foi iniciada por conta da alimentação do gado. Os animais eram alimentados com o chamado meat-and-bone meal (MBM). Ou seja, tecidos com alta concentração de proteínas príon que podem ter vindo de ovelhas infectadas com scrapie (uma encefalopatia comum entre rebanhos destes animais) ou de outros bovinos que desenvolveram a forma esporádica da doença.
Alguns anos mais tarde, na década de 90, a EEB se manifestou em seres humanos e ficou conhecida como variante da doença de Creutzfeldt-Jakob (vCJD). Mais de 200 casos foram reportados, a maior parte no Reino Unido. Desde então, diversos países implementaram rigorosas regras de importação para impedir o contágio, incluindo o Brasil.
Os diagnósticos dessas doenças são feitos com base nos sinais clínicos, que só aparecem após longos períodos de incubação. Até o momento, a confirmação de uma encefalopatia espongiforme só pode ser realizada durante uma autópsia.
Pesquisas na área têm explorado o papel dos íons de cobre na origem e desenvolvimento dessas condições. Como destaca Mariana Juliani do Amaral, autora principal do artigo, “[…] os íons de cobre estão muito presentes na fenda sináptica, que é a região onde os neurônios se comunicam, e nunca estão livres. Eles podem desencadear reações químicas que geram espécie reativas de oxigênio, as chamadas reactive oxygen species (ROS) em inglês. E elas reagem com todas as biomoléculas, incluindo lipídios, proteínas e até DNA, podendo causar mutações ou agregação de proteínas. […] as espécies reativas de oxigênio são um denominador comum em todas as doenças neurodegenerativas. Então esse trabalho é focado na proteína príon, mas ele leva em conta também algo presente em outras doenças.”
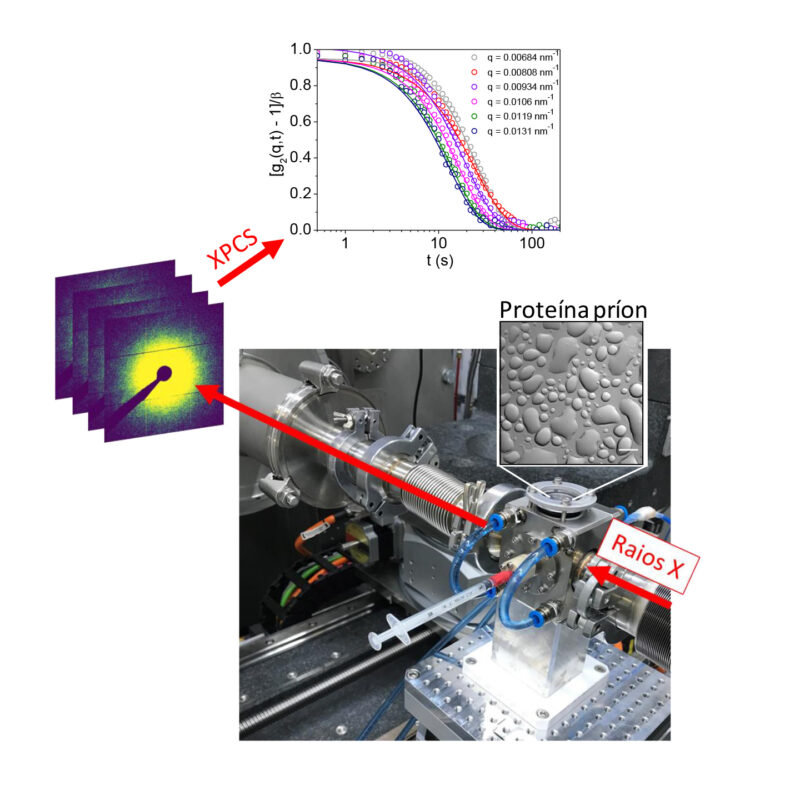
Estudo da dinâmica de agregados de proteína príon por espectroscopia de correlação de fótons de raios X (XPCS) na linha Cateretê do Sirius (Divulgação: CNPEM)
O estudo utilizou técnicas avançadas de análise, como a espectroscopia de correlação de fótons de raios X (XPCS) da linha Cateretê do Sirius, para investigar a dinâmica desses condensados intracelulares. Como destacado por Aline Ribeiro Passos, pesquisadora do CNPEM e coautora do artigo, técnicas de caracterização convencionais trazem informações sobre o todo. Entretanto, as pesquisadoras precisavam de informações sobre os condensados intracelulares, e a coerência do feixe gerado pelo Sirius torna possível fazer este estudo da dinâmica em escala micrométrica e fornece informações quantitativas da fase condensada e da forma líquida ou gel das gotículas de proteína.

Pesquisadoras Mariana Juliani do Amaral (UFRJ), Yraima Cordeiro (UFRJ) e Aline Ribeiro Passos (CNPEM)
O trabalho foi desenvolvido em conjunto com diversas pesquisadoras, incluindo a professora Susanne Wegmann, do German Center for Neurodegenerative Diseases (DZNE), que faz parte de um grupo focado em descrever processos de separação de fase nessas circunstâncias.
As gotículas observadas podem ter concentrações extremamente altas, até 100 vezes maiores que o ambiente circundante. Essas descobertas são vistas como um marco importante na compreensão das interações entre a proteína príon e os íons de cobre, e levantam a hipótese de que essas gotículas podem evoluir para agregados mais estáveis ao longo do tempo, contribuindo para danos celulares e progressão de doenças neurodegenerativas.
“Esta é uma área bastante promissora porque oferece novas oportunidades para tratamento. Nós não sabíamos que havia esse intermediário entre a forma solúvel a forma agregada de proteínas. E essas gotículas líquidas podem ser bons alvos farmacológicos, já a forma agregada não. Se conseguirmos manter a forma líquida dessas gotículas, talvez possamos impedir a progressão dessas doenças neurodegenerativas.”, comenta Mariana.
Ambiente sofisticado e efervescente de pesquisa e desenvolvimento, único no Brasil e presente em poucos centros científicos do mundo, o Centro Nacional de Pesquisa em Energia e Materiais (CNPEM) é uma organização privada sem fins lucrativos, sob a supervisão do Ministério da Ciência, Tecnologia e Inovação (MCTI). O Centro opera quatro Laboratórios Nacionais e é o berço do projeto mais complexo da ciência brasileira – Sirius – uma das fontes de luz síncrotron mais avançadas do mundo. O CNPEM reúne equipes multitemáticas altamente especializadas, infraestruturas laboratoriais globalmente competitivas e abertas à comunidade científica, linhas estratégicas de investigação, projetos inovadores em parceria com o setor produtivo e formação de investigadores e estudantes. O Centro é um ambiente impulsionado pela pesquisa de soluções com impacto nas áreas de Saúde, Energia e Materiais Renováveis, Agroambiental, Tecnologias Quânticas. A partir de 2022, com o apoio do Ministério da Educação (MEC), o CNPEM expandiu suas atividades com a abertura da Ilum Escola de Ciência. O curso superior interdisciplinar em Ciência, Tecnologia e Inovação adota propostas inovadoras com o objetivo de oferecer formação de excelência, gratuita, em período integral e com imersão no ambiente de pesquisa do CNPEM. Por meio da Plataforma CNPEM 360 é possível explorar, de forma virtual e imersiva, os principais ambientes e atividades do Centro, visite: https://pages.cnpem.br/cnpem360/.
Artigo publicado na Communications Materials apresenta resultado expressivo e discute possibilidades trazidas pela técnica aliada a fontes de luz síncrotron
Pesquisa se voltou ao uso de células de bigorna de diamante (DAC) associadas à luz síncrotron para investigação de supercondutores em pressões extremas